甲状腺癌属于位居我国恶性肿瘤发病前十的疾病,据我国2019年的全国癌症报告,近年来甲状腺癌的发病率存在上升的趋势[1]。在美国,甲状腺癌的发病率也在稳步增长[2]。
为了让癌症人群拥有更好的生活质量,全球的科学家们也在不断地努力。过去的十年中,免疫检查点封锁(ICB)技术的出现彻底改变了癌症的免疫治疗领域,改变了癌症患者的治疗方式。作为常见恶性肿瘤,对甲状腺癌的关注自然也不能少。免疫治疗在甲状腺癌的诊治中又起到了怎样的作用呢?
不久前美国科罗拉多大学的研究人员在Nature Reviews子刊Endocrinology发表的文章或许能解决这个问题,为晚期甲状腺癌的治疗提供思路。
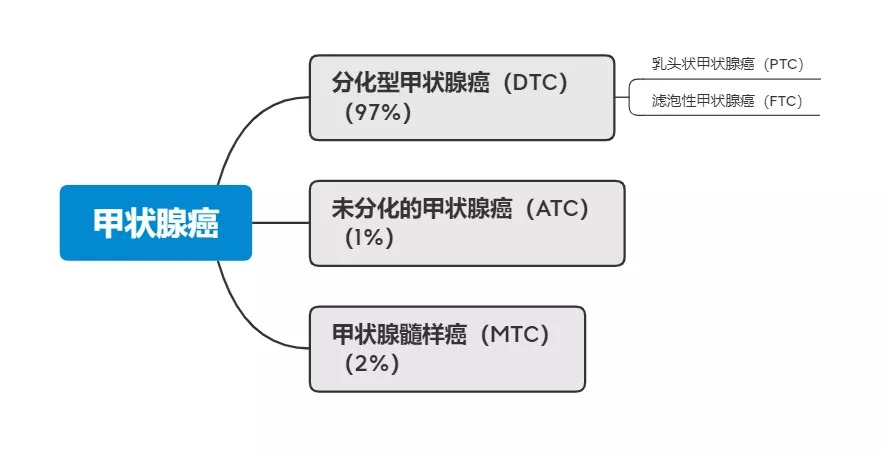
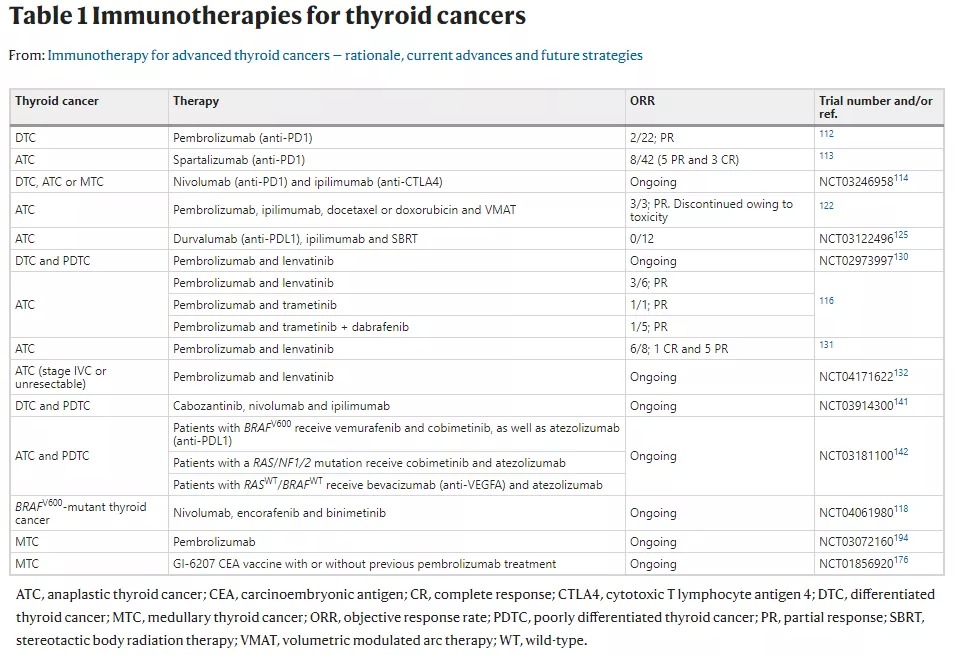
甲状腺癌包含多种组织学肿瘤类型,分化型甲状腺癌(DTC)是最常见的甲状腺癌,约占所有甲状腺癌的97%左右,包含乳头状甲状腺癌(PTC)和滤泡性甲状腺癌(FTC)。未分化的甲状腺癌(ATC)占所有甲状腺癌的1%左右,其余的2%是由甲状腺内产生降钙素的旁滤泡细胞引起的甲状腺髓样癌(MTC)。 甲状腺癌分类结构示意图 研究数据表明,约有7.5%的DTC患者会发生复发,MTC患者的十年生存率为65%,三分之二接受甲状腺切除和淋巴结清扫的MTC患者会出现持续转移性疾病,ATC患者的中位生存期仅3个月,等等。从这些数据不难看出,甲状腺癌患者的治疗仍有很大的进步空间,而患者也将从新的治疗方法中获益。 01 单一疗法易被肿瘤“击溃” 尽管目前临床上有一些甲状腺癌的现行疗法,但针对各型甲状腺癌的治疗都不甚理想。 DTC和ATC患者由于缺乏碘化钠的同向转运表达而对放射碘治疗耐受(RAIR),细胞毒性化疗方案对这些患者也不能产生持久的反应。靶向DTC、ATC、MTC患者关键致癌途径和血管生成途径的多激酶抑制剂由于能够延长患者无进展生存期而成为被批准的疗法。索拉非尼、 酪氨酸激酶抑制剂乐伐替尼可以靶向致癌途径VEGFR2、VEGFR3等,用于治疗RAIR DTC。 而即使使用帕唑帕尼,索拉非尼,氟哌他林等靶向治疗策略,ATC患者的预后也很差,中位生存期小于6个月。乐伐替尼对ATC患者的治疗效果也不佳。达拉菲尼联合曲美替尼使用虽对BRAFV600E阳性的ATC患者有效,但该联合治疗的长期疗效仍不清楚。 MTC的治疗策略是针对RET途径的多激酶抑制剂。凡德他尼、卡博替尼能够使MTC患者病灶部分缓解(PR),但疗效时间不长易产生耐药性。早期临床实验表明高度特异性的RET抑制剂LOXO-292和BLU-667对MTC的治疗效果良好,但其长期疗效尚待确定。 02 崭露头角——免疫疗法 一个多世纪以前科学家们就开始涉及了肿瘤的免疫治疗领域,但直到过去十年ICB治疗的成功才使得免疫治疗肿瘤被肿瘤学家广泛接受,如针对免疫检查点细胞毒性T淋巴细胞相关蛋白4(CTLA4)、程序性死亡受体1(PD-1)的治疗等。 多项研究证实,在MTC等甲状腺癌患者中出现CD4+ T细胞、CD8+ T细胞、CD69等的高表达,表明甲状腺癌患者体内存在明显的T细胞反应。在DTC、ATC、MTC等甲状腺癌亚型中都发现了PD1主要配体细胞程序性死亡-配体1(PDL1)的高表达。为了确定甲状腺癌的抗原靶标,还需要进行其他研究。这些靶标的知识将为晚期疾病患者基于T细胞的免疫疗法的潜力提供重要的依据。 针对晚期甲状腺癌的一些ICB疗法(针对CTLA4、PD1-PDL1轴)都得到了较好的临床证实。在 KEYNOTE-028试验中,用PD1抗体pembrolizumab治疗RAIR DTC患者后,有患者出现PR,表现为35~50%的肿瘤尺寸缩小,还有患者出现约80%的靶向损伤的减少。对进行性ATC患者使用抗PD1单药spartalizumab治疗中出现了19%的客观缓解率(ORR),部分患者出现了肿瘤的完全缓解(CR)或PR,但该药物的反应持久性仍有待确定。尽管这些早期结果令人鼓舞,但可以看到免疫检查点抑制疗法仅使部分患者获得了PR,无法治愈,且在相当多的患者中仍然是无效的。 03 多管齐下战肿瘤 在临床中,有大量案例显示,对第一轮治疗(如阿霉素+顺铂+靶向维莫非尼)无反应的ATC患者采用第二轮的ICB治疗(如抗PD1药nivolumab)后,患者出现明显的临床症状。这些治疗策略目前已经用于降低甲状腺肿瘤负荷,以确保能够进行肿瘤手术切除。 因此,针对肿瘤和免疫反应的新型联合疗法对甲状腺癌可能有更好的效果。肿瘤专家们已经开始在联合治疗领域进行探索。下图展示了部分针对甲状腺癌的免疫疗法及联合疗法。 甲状腺癌的免疫疗法(来源:doi: 10.1038/s41574-020-0398-9) 现有的联合疗法有以下几种: 一是同时针对肿瘤细胞和肿瘤微环境的联合疗法,以提高ICB治疗甲状腺癌的疗效。如针对RAIR BRAF600突变的甲状腺癌,正在进行BRAF抑制剂encorafenib+MEK抑制剂binimetinib与抗PD1药nivolumab的研究。BRAFV600E黑色素瘤细胞系中BRAF-MAPK信号的抑制降低了IL-10和VEGF的表达,这有助于免疫抑制。因此,阻断BRAF-MEK信号传导的治疗方法可能会增强ICB治疗后的T细胞激活。 二是放化疗结合抗PD1、抗PDL1、抗CTLA4的疗法。ICB与放疗的结合是基于放疗会引起肿瘤损伤,增加新抗原提呈,刺激肿瘤特异性T细胞活化,从而进一步增强ICB治疗效果。但目前一些相关的研究或暂无明显疗效,或暂时取得较好的疗效但患者中位生存期低,仍待进一步研究。 三是靶向 VEGF和/或VEGFR及ICB疗法的结合。这是由于VEGF和/或VEGFR的抑制被认为可以逆转肿瘤微环境中的免疫抑制。已有报道表明,lenvatinib和pembrolizumab联合治疗晚期ATC(7例)或PDTC(1例)患者的ORR为75%(8个患者中有6个),5个患者观察到PR,1个患者观察到CR。当前还有一些临床试验正在持续研究pembrolizumab联合lenvatinib治疗甲状腺癌患者的疗效。以VEGFR2、MET、AXL和RET为靶点的cabozantinib联合nivolumab(抗PD1)和ipilimumab(抗CTLA4)也可能存在较好的治疗效果。 在甲状腺癌领域,ICB与其他治疗的联合疗法正激起着专家学者们的无线热情。这些早期研究的结果将为晚期肿瘤患者的下一阶段治疗提供更多的依据。 而在新型的联合疗法探索过程中,了解晚期甲状腺癌患者对目前基于免疫方法的治疗的反应及耐药性机制也非常必要,专家们也在进行大量的工作,如建立生理相关的临床前模型,以便更好地评估该疗法的机制。目前常用的有3种模型,包括免疫反应的同基因原位模型,甲状腺特异性、甲状腺过氧化物酶启动子驱动的转基因模型和诱导型甲状腺特异性转基因模型。 同基因小鼠肿瘤系容易生长,可以在体外操纵,研究可以快速进行。然而,这些细胞系不能再现在人类肿瘤中观察到的异质性,而且往往生长过快,不允许抗肿瘤免疫反应的发展,无法建立与生理相关的微环境。因此未来使用可诱导的、生长缓慢的肿瘤模型的研究非常有必要,以便更好地了解在临床前环境下对免疫治疗的反应和耐药性的机制。 目前来看,甲状腺癌的治疗策略正在进步,部分晚期甲状腺癌患者能从新型联合疗法中受益,但未来的进展空间还很大,新型联合疗法仍待继续研究。 参考资料 [1] 健康界. 国家癌症中心最新发布:2019年全国癌症报告》. 2019-06-23 [2] French JD. Immunotherapy for advanced thyroid cancers - rationale, current advances and future strategies. Nat Rev Endocrinol. 2020;16(11):629-641. doi:10.1038/s41574-020-0398-9